12月7日,國際學(xué)術(shù)期刊Nature Immunology雜志在線(xiàn)發(fā)表中國科學(xué)院上海營(yíng)養與健康研究所王瑩研究組和時(shí)玉舫研究員題為“Oleic Acid Availability Impacts Thymocyte Preprogramming and Subsequent Peripheral Treg Cell Differentiation”的研究成果。該研究發(fā)現胸腺基質(zhì)微環(huán)境中油酸可利用性影響并賦予發(fā)育中T細胞的表觀(guān)遺傳學(xué)印記,決定其成熟后向調節性T細胞(regulatory T cells, Treg)分化的潛能,揭示T細胞分化命運調控的新窗口與新機制。
外周初始CD4+ T細胞識別抗原并在特定因素刺激下被活化,分化為具有不同功能的T細胞亞群,如Th1、Th17、Th2、Treg,是機體免疫應答與免疫調控的核心。以往研究從抗原濃度與親和力、共刺激與共抑制分子信號、炎癥因子類(lèi)型和代謝調控等多角度,揭示了初始CD4+ T細胞分化為不同亞群的調控特征與機制。然而,是否外周初始CD4+ T細胞向不同亞群分化的能力可以被其在胸腺發(fā)育過(guò)程中所接觸的微環(huán)境信號所決定仍不清楚。該研究發(fā)現,胸腺細胞的雙陰性(DN)階段是決定外周Treg分化命運的重要調控窗口,易于受到胸腺基質(zhì)微環(huán)境中油酸可利用性的影響,為理解CD4+ T細胞的免疫調節提供新視角。
硬脂酰輔酶A去飽和酶(stearoyl CoA desaturase, SCD)是催化來(lái)源于食物或者從頭合成的飽和脂肪酸轉變?yōu)閱尾伙柡椭舅幔ㄓ退崤c棕櫚油酸)的限速酶。其中,人類(lèi)基因組中的2個(gè)SCD基因均與小鼠SCD1基因高度同源。研究發(fā)現,SCD1缺失顯著(zhù)促進(jìn)小鼠外周血、淋巴結以及主要組織器官中Foxp3+ Treg的數量與比例,并賦予其抵抗自身免疫性疾病的能力,這一現象與SCD1缺失促進(jìn)初始CD4+ T細胞向Treg分化密切相關(guān)。利用條件性敲除小鼠、骨髓移植、胸腺移植和T細胞體外發(fā)育等體系,研究揭示SCD1在胸腺上皮細胞中的缺失是導致初始CD4+ T細胞向Treg的分化傾向性增加的主要原因,而非SCD1在T細胞中缺失所引起。更為重要的是,胸腺上皮細胞油酸的可利用性影響初始CD4+ T細胞向Treg分化潛能的關(guān)鍵窗口期是胸腺細胞DN2向DN3的發(fā)育階段。在油酸缺乏的胸腺微環(huán)境中,胸腺細胞內表觀(guān)遺傳修飾酶DOT1L活性上調,借以H3K79me2修飾促進(jìn)DN3胸腺細胞中Atp2a2基因座的染色質(zhì)開(kāi)放水平。這一表觀(guān)遺傳學(xué)印記從DN3階段一直保留至初始CD4+ T細胞,使其在接受T細胞受體激活信號時(shí),通過(guò)ATP2A2——calcium——NFAT——Foxp3信號軸促進(jìn)其向Treg分化。該項研究首次揭示胸腺基質(zhì)微環(huán)境中的油酸信號影響和預編程外周T細胞亞群分化偏好性的細胞與分子機制,不僅為理解不同生理病理環(huán)境中T細胞免疫調控機制提供了新視角,也為T(mén)reg的定向高效誘導及其在器官移植、自身免疫性疾病等治療中的應用提供新策略與新方向。
中國科學(xué)院上海營(yíng)養與健康研究所博士后林良宇、博士生胡明源為該論文的共同第一作者。中國科學(xué)院上海營(yíng)養與健康研究所王瑩研究員、時(shí)玉舫研究員為論文的共同通訊作者。該工作得到中國科學(xué)院上海營(yíng)養與健康研究所孔祥銀研究員、中國科學(xué)院干細胞與再生醫學(xué)創(chuàng )新研究院王金勇研究員、以及上海科技大學(xué)林立副研究員的合作支持。研究工作獲得科技部國家重點(diǎn)研發(fā)計劃項目、國家自然科學(xué)基金委的資助,以及中國科學(xué)院上海營(yíng)養與健康研究所所級公共技術(shù)中心的支持。
原文鏈接:https://www.nature.com/articles/s41590-023-01672-1
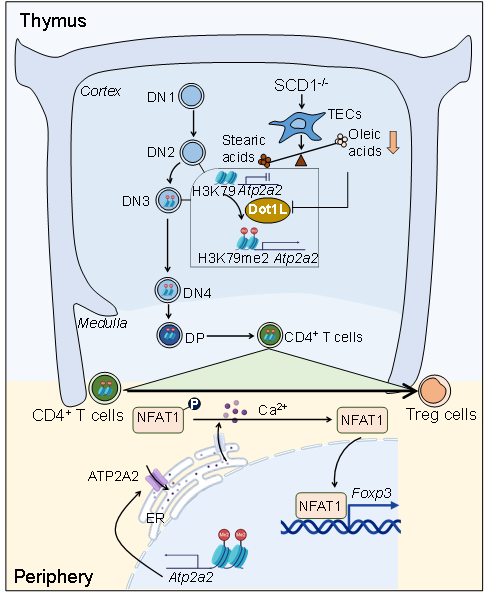
圖例:胸腺基質(zhì)微環(huán)境中油酸的可利用性影響發(fā)育中T細胞,預編程其成熟后向Treg分化的細胞與分子機制